
Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Nowe badanie łączy wysoki poziom trójglicerydów z rozwojem tętniaka aorty i jego pęknięciem
Ostatnia recenzja: 18.08.2025
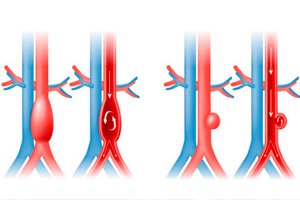 ">
">Artykuł opublikowany w czasopiśmie „Circulation” łączy genetykę człowieka z modelami eksperymentalnymi, aby dojść do prostego wniosku: hipertriglicerydemia nie jest jedynie „towarzyszką” chorób sercowo-naczyniowych, ale kluczowym czynnikiem rozwoju tętniaka aorty brzusznej (AAA). W modelach mysich bardzo wysokie stężenie TG prowadziło do przyspieszonego wzrostu tętniaka, jego rozwarstwienia, a nawet pęknięcia, podczas gdy obniżenie stężenia TG (ASO do ANGPTL3) spowalniało progresję. Mechanizm działania polega na tym, że kwasy tłuszczowe (palmitynian) „zatrzymują” dojrzewanie oksydazy lizylowej (LOX), enzymu, który „wiąże” elastynę i kolagen w ścianie aorty; bez prawidłowego stężenia LOX tkanka staje się luźna i podatna na uszkodzenia. U ludzi randomizacja mendlowska potwierdziła związek przyczynowo-skutkowy między lipoproteinami bogatymi w TG a ryzykiem wystąpienia AAA.
Tło badania
Dlaczego tętniak aorty brzusznej (AAA) stanowi nierozwiązany problem kliniczny?
Tętniak aorty brzusznej (AAA) to „cichy” stan, charakteryzujący się wysoką śmiertelnością w przypadku pęknięcia; nie ma skutecznych leków, które skutecznie spowalniałyby jego wzrost. Obecnie strategia opiera się na badaniach ultrasonograficznych w grupach ryzyka oraz operacji po osiągnięciu progu średnicy. Zalecenia USPSTF: pojedyncze badanie przesiewowe u mężczyzn w wieku 65–75 lat, którzy kiedykolwiek palili; u kobiet bez czynników ryzyka – niezalecane.
Co próbowano wcześniej i dlaczego się nie sprawdziło?
Wiele podejść „antydegradacyjnych” (np. doksycyklina jako inhibitor metaloproteinazy macierzy) nie zdołało spowolnić wzrostu małych AAA w badaniach RCT, co osłabiło nadzieje na prostą terapię przeciwzapalną/przeciwmacierzową.
Rola lipidów: uwaga skupia się na cząsteczkach bogatych w triglicerydy.
Podczas gdy LDL-C pozostaje kluczowym czynnikiem w chorobie wieńcowej, w przypadku tętniaka aorty brzusznej (AAA) coraz więcej danych wskazuje na lipoproteiny bogate w triglicerydy (TRL, resztkowe). Współczesne badania przeglądowe i genetyczne (w tym randomizacja mendlowska) potwierdzają związek przyczynowo-skutkowy między podwyższonym stężeniem TG/TRL a ryzykiem wystąpienia tętniaka aorty brzusznej. Nowy artykuł w czasopiśmie „Circulation” (2025) połączył analizy i eksperymenty MR i doprowadził do tych samych wniosków.
Mechanika ścian naczyń: gdzie jest „subtelnie”
Wytrzymałość aorty jest determinowana przez „wiązania poprzeczne” kolagenu i elastyny, za które odpowiada oksydaza lizylowa (LOX). Rodzina LOX stabilizuje macierz zewnątrzkomórkową; gdy jej niedobór/zahamowanie powoduje, że aorta staje się luźna i podatna na rozszerzanie – co potwierdzają zarówno badania przeglądowe, jak i modele eksperymentalne.
Dlaczego ANGPTL3 jest atrakcyjnym celem?
ANGPTL3 hamuje lipazę lipoproteinową; jego hamowanie drastycznie obniża poziom TG (i częściowo innych lipidów). Istnieje już zatwierdzony lek przeciwko ANGPTL3 (evinacumab), a metody RNA są opracowywane – to znaczy, istnieją „narzędzia” do klinicznego testowania hipotezy „obniżenie poziomu TG → hamowanie AAA”.
Podsumowanie kontekstu.
Dziedzina przesuwa się od „uniwersalnych” idei przeciwzapalnych w kierunku osi lipidowo-macierzowej: TRL/TG → zaburzenie dojrzewania macierzy i „sieciowania” (w tym poprzez LOX) → osłabienie ściany aorty → wzrost/pęknięcie tętniaka aorty brzusznej (AAA). W tym kontekście praca opublikowana w czasopiśmie „Circulation” logicznie testuje związek przyczynowo-skutkowy z genetyką i pokazuje w modelach, że korekcja TG może spowolnić progresję – jest to pomost między epidemiologią a mechanizmem, którego brakowało do rozpoczęcia badań klinicznych.
Co dokładnie zrobili?
- Ludzie (genetyka): zastosowano randomizację mendlowską, łącząc dane genomiczne, proteomiczne i metabolomiczne, uzyskując sygnał przyczynowy: im wyższe stężenie lipoprotein bogatych w TG i białek/metabolitów związanych z metabolizmem TG, tym wyższe ryzyko wystąpienia AAA.
- Mechanizm (komórki/tkanka): wykazano, że podwyższony poziom TG i palmitynianu zaburza dojrzewanie LOX i zmniejsza jego aktywność → ściana aorty traci swoje „wiązania poprzeczne”, rozszerza się i łatwiej pęka. Lokalna nadmierna ekspresja LOX w aorcie zniwelowała „szkodliwość” hipertriglicerydemii.
- Myszki (modele AAA):
- w przypadku niedoboru Lpl (skrajnej hipertriglicerydemii) większość zwierząt w modelu angiotensyny II umierała na skutek pęknięcia aorty;
- Apoa5-/- (umiarkowanie wysokie TG) - przyspieszony wzrost tętniaka aorty brzusznej;
- transgeniczne dla ludzkiego APOC3 (bardzo wysokie TG) - rozwarstwienie i pęknięcie.
- Terapeutyczny dowód słuszności koncepcji: oligonukleotyd antysensowy ANGPTL3 znacząco zmniejszył poziom TG i zahamował postęp AAA u transgenicznych myszy APOC3 i Apoe-/-.
Dlaczego to jest ważne?
Tętniak aorty brzusznej to utajona i śmiertelna choroba: pęknięcie często kończy się zgonem, a praktycznie nie ma skutecznych leków spowalniających wzrost tętniaka aorty brzusznej (podstawą jest obserwacja/badania przesiewowe i leczenie operacyjne po osiągnięciu progu wzrostu tętniaka). Nowe badania, po raz pierwszy w ujęciu ścisłym i wieloliniowym (genetyka → mechanizmy → modele), pokazują, że lipoproteiny bogate w TG są kluczowym ogniwem w patogenezie, a ich celowana redukcja może stać się strategią leczenia AAA.
Szczegóły, na które należy zwrócić uwagę
- LOX jako „słaby punkt” ściany aorty. Lizyloksydaza „sieciuje” włókna elastyny i kolagenu. Autorzy wykazali, że palmitynian zakłóca dojrzewanie LOX, co stanowi bezpośredni pomost między metabolizmem tłuszczów a wytrzymałością mechaniczną aorty. Po sztucznym zwiększeniu stężenia LOX w miejscu tętniaka, efekt przeciwtętniakowy powrócił, pomimo wysokiego stężenia TG.
- „Dowód odwrotny”: farmakologiczna redukcja TG (ANGPTL3-ASO) zahamowała AAA w dwóch niezależnych modelach, wzmacniając wiarygodność kliniczną.
Co to oznacza (potencjalnie) dla kliniki?
- Nowy cel – lipoproteiny bogate w TG. Badania przeprowadzone w ostatnich latach przesunęły punkt ciężkości AAA z „czystego LDL” na stan zapalny i przebudowę macierzy pozakomórkowej. W tym przypadku dodane zostaje twarde połączenie z TG, z wyraźnym mechanizmem działania za pośrednictwem LOX. Otwiera to przestrzeń dla badań profilaktycznych/terapeutycznych leków obniżających poziom TG – od hamowania ANGPTL3 po inne szlaki korygujące metabolizm TG.
- Biomarkery i stratyfikacja ryzyka: Jeśli związek zostanie potwierdzony w prospektywnych kohortach, poziomy TG i cząstek bogatych w TG mogą zostać uwzględnione w algorytmach oceny ryzyka i selekcji w celu dokładniejszego monitorowania pacjentów z małym/umiarkowanym tętniakiem aorty brzusznej.
Ważne zastrzeżenia
- Myszy to nie ludzie: efekt terapeutyczny ANGPTL3-ASO i naprawa LOX potwierdzona w modelach przedklinicznych; brak jeszcze danych klinicznych. Konieczne są badania RCT w celu sprawdzenia, czy redukcja TG spowalnia wzrost tętniaków aorty brzusznej u ludzi.
- MR – o związku przyczynowo-skutkowym, ale „średnio”. Randomizacja mendlowska redukuje czynniki zakłócające, ale mówi o dożywotnim, genetycznie uwarunkowanym wzroście TG, a nie o krótkoterminowych wahaniach u konkretnego pacjenta. Przejście do interwencji farmakologicznej wymaga niezależnego testu.
Kontekst: Dlaczego to odkrycie ma sens
Obraz przedstawia się następująco: lipoproteiny bogate w TG → kwasy tłuszczowe (palmitynian) → defekt LOX → osłabiona ściana aorty → wzrost/pęknięcia tętniaka aorty brzusznej (AAA). Wcześniej tętniak aorty brzusznej (AAA) wiązał się ze stanem zapalnym, degradacją macierzy zewnątrzkomórkowej i dysfunkcją mięśni gładkich; ta nowa praca umieszcza składnik lipidowy w samym sercu tych procesów – i dostarcza sprawdzony „przycisk” interwencji (obniżenie stężenia TG).
Źródło: Liu Y. i in. Circulation (Publish Ahead of Print, 5 sierpnia 2025 r.): „Hipertriglicerydemia jako kluczowy czynnik przyczyniający się do rozwoju i pęknięcia tętniaka aorty brzusznej: wnioski z modeli genetycznych i eksperymentalnych”. https://doi.org/10.1161/CIRCULATIONAHA.125.0747
