
Cała zawartość iLive jest sprawdzana medycznie lub sprawdzana pod względem faktycznym, aby zapewnić jak największą dokładność faktyczną.
Mamy ścisłe wytyczne dotyczące pozyskiwania i tylko linki do renomowanych serwisów medialnych, akademickich instytucji badawczych i, o ile to możliwe, recenzowanych badań medycznych. Zauważ, że liczby w nawiasach ([1], [2] itd.) Są linkami do tych badań, które można kliknąć.
Jeśli uważasz, że któraś z naszych treści jest niedokładna, nieaktualna lub w inny sposób wątpliwa, wybierz ją i naciśnij Ctrl + Enter.
Jak zarodek „wgryza się” w tkankę matki: mechanika implantacji u ludzi sfilmowana po raz pierwszy w czasie rzeczywistym
Ostatnia recenzja: 23.08.2025
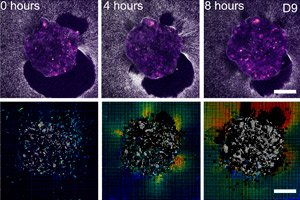 ">
">Naukowcy z Barcelony (IBEC, Dexeus Mujer) i Tel Awiwu po raz pierwszy zaprezentowali w czasie rzeczywistym i w 3D, jak ludzki zarodek przyczepia się do „rusztowania macicy” i dosłownie naciąga i restrukturyzuje otaczającą tkankę. W tym celu stworzyli odkształcalną platformę ex vivo (żele kolagenowe/ECM) i zastosowali mikroskopię sił trakcyjnych bezpośrednio do żywych embrionów ludzkich i mysich. Kluczowe odkrycie: układ sił jest specyficzny dla gatunku, a same zarodki są wrażliwe na działanie mechanizmów: reagują na zewnętrzne bodźce mechaniczne, restrukturyzując cytoszkielet i zmieniając orientację wzrostu.
Tło badania
Implantacja jest „wąskim gardłem” ludzkiej reprodukcji: to właśnie na tym etapie zarówno naturalne poczęcia, jak i próby zapłodnienia in vitro najczęściej kończą się niepowodzeniem. Jednocześnie implantacja u ludzi ma charakter śródmiąższowy: zarodek nie tylko „przykleja się”, ale zostaje całkowicie osadzony w endometrium – jest to złożony proces biochemiczny i mechaniczny, do niedawna praktycznie nieobserwowany w żywych organizmach ludzkich. Dlatego mechanizmy adhezji i inwazji pozostawały „czarną skrzynką”, a wnioski często wyciągano na podstawie pośrednich markerów lub danych z modeli zwierzęcych.
Klasyczna biologia implantacji w dużej mierze opierała się na myszach, ale istnieją fundamentalne różnice między gatunkami, od orientacji blastocysty po głębokość implantacji i wzorzec sił komórkowych. U myszy implantacja jest bardziej „powierzchniowa”, z preferencjami co do kierunków przemieszczania tkanek; u ludzi jest ona wyraźnie inwazyjna, z wieloogniskowymi siłami trakcyjnymi wokół zarodka. Te różnice sugerują, że model mysi nie zawsze jest skalowalny do ludzkiego, zwłaszcza pod względem mechaniki. Konieczne były bezpośrednie obserwacje ludzkiego zarodka w środowisku odkształcalnym.
Przełom technologiczny stał się możliwy dzięki połączeniu odkształcalnych matryc 2D/3D (kolagen/ECM) i mikroskopii sił trakcyjnych z długoterminowym obrazowaniem wysokoczęstotliwościowym. Ta „sztuczna macica” umożliwiła dosłowne zobaczenie i zmierzenie, jak zarodek ciągnie, restrukturyzuje i „wierci” otaczającą tkankę – oraz jak reaguje na zewnętrzne bodźce mechaniczne (mechanowrażliwość). Otwiera to drogę do nowych kryteriów oceny potencjału implantacyjnego i precyzyjnego dostrojenia warunków transferu zarodka.
Zastosowano kontekst: jeśli właściwości mechaniczne środowiska i układ sił embrionalnych są powiązane z sukcesem implantacji, to w zapłodnieniu in vitro możliwe jest celowe dobranie sztywności/składu macierzy, uwzględnienie okien czasowych transferu, a nawet wykorzystanie wskaźników „siły” jako dodatkowego wskaźnika selekcji. Jednocześnie takie platformy pomogą wyjaśnić odsetek wczesnych poronień, gdy biochemia jest „prawidłowa”, ale mechanika adhezji nie. Wszystko to sprawia, że bezpośrednie, trójwymiarowe obserwacje implantacji u ludzi to nie tylko piękny film, ale nowe narzędzie w medycynie rozrodu.
Dlaczego to jest ważne?
Niepowodzenie implantacji jest jedną z głównych przyczyn niepłodności i odpowiada za nawet 60% samoistnych poronień. Pomimo biochemicznego postępu w zapłodnieniu in vitro, mechanizmy tego procesu u ludzi pozostają niejasne. Nowe podejście pozwala nam dostrzec siły i trajektorie implantacji zarodka oraz stanowi podstawę do poprawy selekcji zarodków i warunków transferu.
Jak to zrobiono
Naukowcy zbudowali „sztuczną macicę” – miękkie, przezroczyste i odkształcalne środowisko, w którym tkankopodobna matryca widocznie przesuwa się pod wpływem sił embrionalnych. Następnie przeprowadzono ciągłą mikroskopię i analizę obliczeniową przemieszczeń włókien.
- Platformy 2D i 3D: w przypadku technologii 3D zarodek jest od razu umieszczany w matrycy (etap przyczepiania jest „pominięty”), co pozwala na obserwację wiercenia w grubości tkanki.
- Wysoki wskaźnik „przetrwania i penetracji” w 3D: około 80% udanych inwazji (ograniczone przez bliskość szkła).
- Mapy trakcji i cyfrowa korelacja objętości pokazują amplitudy i kierunki przemieszczeń wokół zarodka – w zasadzie jest to „odcisk” siły w czasie.
Co dokładnie zostało znalezione (krótko i punkt po punkcie)
1) Specyficzne dla gatunku mechanizmy implantacji
- Człowiek: zarodek zostaje wprowadzony do macierzy, co powoduje powstanie licznych ognisk trakcji i formowanie wokół siebie promieniście jednorodnych przemieszczeń; głębokość inwazji wynosi do 200 µm.
- Mysz: zarodek rozprzestrzenia się głównie po powierzchni, z wyraźnie zaznaczonymi głównymi kierunkami przemieszczania.
2) Zarodek wyczuwa mechanizmy środowiska
- Siły zewnętrzne → odpowiedź: w zarodku ludzkim - rekrutacja miozyny i skierowane pseudopodia komórkowe; w myszy - obrót osi implantacji/wzrostu w kierunku źródła siły zewnętrznej (orientacja osi PD).
- Markery wrażliwe na mechanizmy: u myszy przesunięcia w lokalizacji YAP w trofoblaście; łącznie wskazują one na istnienie obwodu sprzężenia zwrotnego wrażliwego na mechanizmy.
3) Związek pomiędzy siłą a sukcesem implantacji
- Mniejsze przemieszczanie kolagenu → gorszy postęp implantacji w ludzkich zarodkach.
- Integryny – „sprzęgacz” siły: blokada peptydu RGD/hamowanie Src u myszy zmniejsza głębokość/obszar implantacji.
Jak wygląda wdrożenie?
- Na platformach 2D i 3D wokół zarodka tworzy się rosnąca „aureola” przemieszczeń włókien; mapa trakcji pulsuje, jakby zarodek „skanował” swoje otoczenie.
- Na szkle ludzki zarodek tworzy płaską narośl, natomiast w miękkiej matrycy zachowuje bardziej kulisty kształt i wnika głębiej – jak w żywą tkankę.
Co to daje praktyce (perspektywy dla zapłodnienia in vitro i nie tylko)
Idea jest prosta: implantacja to nie tylko „chemia receptorów”, ale także mechanika adhezji i trakcji. Oznacza to, że możemy zoptymalizować:
- Materiały i twardość medium podczas badań potencjału kulturowego/implantacyjnego;
- Nowe markery do selekcji zarodków – oparte na trajektoriach i amplitudzie przemieszczeń w „inteligentnej” matrycy;
- Trening/modulacja macicy (np. poprzez delikatne bodźce mechaniczne) w celu poprawy przylegania bez agresywnych interwencji.
Uwaga: praca ex vivo nie odbywa się „wewnątrz macicy”. Jednak sam fakt, że zewnętrzny sygnał mechaniczny zmienia orientację implantacji/organizację osi, otwiera drogę do spersonalizowanych warunków transferu zarodka.
Ograniczenia
- Model ex vivo nie bierze pod uwagę dynamiki immunologicznej, hormonalnej i naczyniowej prawdziwego endometrium;
- Matrigel/kolagen definiują zestaw właściwości (sztywność, lepkosprężystość, skład), trudno jest je zmienić za pomocą jednego parametru;
- Ograniczenia etyczne badań na ludziach (okres do 14 dni) ograniczają możliwość długoterminowej obserwacji. Jednak wysoka zgodność ze znanymi metodami implantacji in vivo (śródmiąższowa u ludzi vs. powierzchniowa u myszy) zwiększa zaufanie do tego modelu.
Wniosek
Ludzki embrion aktywnie „wciąga” i „wierci” drogę do tkanek matki, a mechaniczne bodźce ze środowiska mogą zmieniać jego zachowanie. Wzór sił i strategia implantacji różnią się u ludzi i myszy – co może wyjaśniać, dlaczego model mysi nie zawsze przewiduje pomyślną implantację u ludzi. Mechanika odgrywa obecnie ważną rolę we wczesnej embriologii i medycynie rozrodu.
Źródło: Godeau AL i in. Siła trakcji i wrażliwość mechaniczna pośredniczą w specyficznych dla gatunku wzorcach implantacji u zarodków ludzkich i mysich. Science Advances 11(33): eadr5199 (15 sierpnia 2025). DOI: 10.1126/sciadv.adr519
